RöKo 2023 – Multiparametrische MRT der Mamma

Die Wahl der Sequenzen innerhalb einer multiparametrischen Mamma-MRT richtet sich nach dem Zweck des Scans. Für die Diagnose sind mehrere Sequenzen nötig, für Detektion und Therapiemonitoring kann eine Zusatzsequenz reichen.
-
Präsentationstag:17.05.2023 0 Kommentare
-
Autor:kf/ktg
-
Sprecher:Sabine Ohlmeyer, Universität Erlangen
-
Quelle:RöKo 2023
Als „Zutaten“ für eine multiparametrische (mp) Mamma-MRT stehen derzeit T1- und T2-gewichtete Sequenzen, die Kontrastmitteldynamik und die Diffusionswichtung (DWI) zur Verfügung. Die Empfehlungen zum optimalen Protokoll unterscheiden sich je nach Fachgesellschaft leicht. Sabine Ohlmeyer, Erlangen, empfahl das folgende mpMRT-Basisprotokoll – es stammt aus einer Arbeit von Baltzer et al. (2022), die den Kaiser-Score als klinische Entscheidungsregel für die mpMRT erläutert:
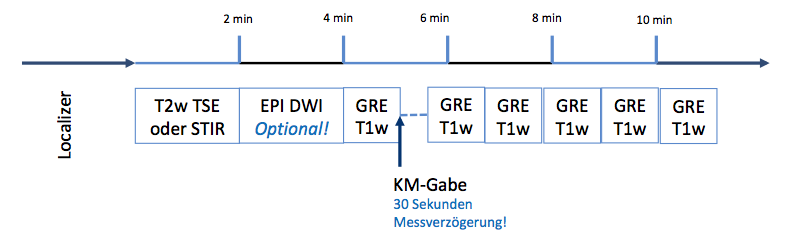
Das Basisprotokoll startet mit einer T2w Messung. Alternativ oder additiv kann die STIR (Short-Tau-Inversion-Recovery-Sequenz) eingesetzt werden. Die Dynamik beginnt mit der nativen T1w Messung. Dem folgt die i.v.-KM-Gabe und eine Pause von 30 Sekunden. Abschließend identische T1w Messungen. Ein DWI-Sequenz ist optional, aber empfehlenswert.
TSE: Turbo-Spin Echo/Fast Spin Echo; EPI: Echo Planar Imaging, DWI: Diffusion Weighted Imaging, GRE: Gradientenecho, KM: Kontrastmittel (in Baltzer et al. 2022: gadoliniumhaltiges makrozyklisches Kontrastmittel)
Nach: Baltzer et al. 2022
T2-Wichtung
T2-gewichtete Sequenzen vor der Kontrastmittelgabe – alternativ SE, IR oder FSE/TSE-Sequenzen mit oder ohne Fettunterdrückung – sind dazu da, die Anatomie der Brust darzustellen, die Läsion/en zu charakterisieren und Tumorödem und Lymphknoten darzustellen. Die Schichtauflösung sollte maximal 1mm x 1mm betragen, die Schichtdicke maximal 3mm.
DWI
Das Ziel der Diffusionswichtung ist die Detektion und Charakterisierung von Mamma-Läsionen. Die DWI sollte mittels Echo-Planar-Imaging(EPI)-Sequenz durchgeführt werden. Dabei sind mindestens zwei Diffusionsparameter (b-Werte) zu wählen, wobei der kleine bei maximal 50 s/mm2, idealerweise nahe 0 s/mm2 liegen sollte und der hohe bei circa 800 s/mm2. Bei Betrachtung der Bilder im Verlauf verschiedener b-Werte (von gering nach hoch) zeigt sich, dass die Signalabnahme bei Tumoren oft am geringsten ausfällt.
Die Fettsättigung wird benötigt, empfohlen wird SPAIR (SPectral Attenuated Inversion Recovery). Die Echozeit (TE) sollte so klein wie möglich gewählt werden, die Repetitionszeit (TR) sollte bei mindestens 3000ms liegen. Als Schichtauflösung empfiehlt sich maximal 2 x 2mm2, die Schichtdicke sollte maximal 4mm betragen. Um Verzerrungen zu reduzieren, sollte die parallele Bildgebung mit einem Faktor ≥2 erfolgen. Mit der DWI werden ADC-Karten berechnet: Hohe ADC-Werte sprechen gegen Malignität.
Dass der ADC als Parameter für das Therapieansprechen gelten kann, zeigen Studien der letzten Jahre, beispielsweise das ACRIN 6698 Multicenter Trial (Partridge 2018): Die Veränderung des ADC-Werts über einen Zeitraum von 12 Wochen konnte das Ansprechen der neoadjuvanten Therapie prognostizieren.
T1-Wichtung mit Kontrastmitteldynamik
Die T1w stellt ebenfalls die Anatomie dar und dient der Läsionscharakterisierung, sie zeigt Architekturstörungen im Brustgewebe und über die KM-Dynamik lässt sich die Malignität einer Läsion erkennen.
T1w sollte als axiale 3D-GE-Sequenz (in-phase) mit oder ohne Fettunterdrückung mit einer Serie vor und mindestens drei Serien nach KM-Gabe erfolgen. Die zeitliche Auflösung der Einzelsequenzen sollte bei maximal 1,5 Minuten liegen, die Gesamtuntersuchungsdauer nach KM-Gabe mindestens 5 Minuten betragen. Ohne Fettunterdrückung ist die Nachverarbeitung als Subtraktionsbild erforderlich. Um eine Übersicht über die Läsionen zu erhalten, sollte mindestens eine MIP (Maximum Intensity Projection) rekonstruiert werden und zwar aus einem Datensatz 2 Minuten nach KM-Gabe.
Das Kontrastmittelanreicherungsverhalten unterstützt die Einschätzung der Malignität einer Läsion gerade in Zweifelsfällen. Rund 85% der invasiven Mammakarzinome zeigen einen schnellen KM-Inflow, der kaum oder nur langsam abflacht (Kurventyp II oder III). Diesen Kurventyp weisen nur 5% der gutartigen Läsionen auf. Normalerweise zeigen gutartige Läsionen eine langsame Anflutung (Kurventyp Ia).
Weitere Sequenzen und KI
Der Nutzen weiterer Sequenzen für die mpMRT gleicht derzeit dem Blick in die Glaskugel. DWI-Techniken wie Kurtosis, Diffusions-Tensor-Bildgebung oder andere Fatsat-Techniken haben ihre Vorteile noch nicht bewiesen. Das Gleiche gilt für die Spektroskopie, das Quantitative Susceptibility Mapping (QSM) oder die Molekulare Bildgebung mit der MRT (Chemical Exchange Saturation Transfer, CEST).
Künstliche-Intelligenz-Algorithmen haben ihren Nutzen bereits gezeigt: Beispielsweise hat eine Subanalyse der DENSE-Studie gezeigt, dass die automatisierte Analyse von Mamma-MRT-Scans bei Frauen mit dichtem Brustgewebe fast 40 Prozent der läsionsfreien Fälle aussortiert, ohne dabei ein Mammakarzinom zu übersehen (Verburg 2022).
Fazit
Entscheidend für die Auswahl der Techniken und Parameter innerhalb der mpMRT ist der Zweck der Untersuchung. Jede Sequenz hat aktuell bei entsprechender Indikation ihre Berechtigung.
Derzeit decken weder verkürzte KM-MRT-Protokolle noch die diffusionsgewichtete MRT alle Aspekte ab: Bei der KM-MRT fehlt die DWI zur Charakterisierung der Läsionen. Bei der DWI-MRT fehlen die nativen Sequenzen zur anatomischen Darstellung der Brust. Einen klaren Cut-Off-Wert für die Unterscheidung maligne versus benigne wie bei der Prostata gibt es derzeit nicht.
Referenzen
Baltzer PA et al. Evidenzbasierte und strukturierte Diagnostik in der MR-Mammografie anhand des Kaiser-Score. Fortschr Röntgenstr 2022; 194: 1216-28
Partridge SC et al. Diffusion-weighted MRI Findings Predict Pathologic Response in Neoadjuvant Treatment of Breast Cancer: The ACRIN 6698 Multicenter Trial. Radiology 2018;289(3):618-27
Verburg E et al. Deep Learning for Automated Triaging of 4581 Breast MRI Examinations from the DENSE Trial. Radiology 2022;302:29–36
Woodhams R et al. ADC mapping of benign and malignant breast tumors. Magn Reson Med Sci 2005;4(1):35-42